近日,公司现代微生物技术团队何定庚教授在纳米酶高效抗菌研究领域取得重要进展,研究成果以“An Ultrasmall Fe3O4-Decorated Polydopamine Hybrid Nanozyme Enables Continuous Conversion of Oxygen into Toxic Hydroxyl Radical via GSH-Depleted Cascade Redox Reactions for Intensive Wound Disinfection”为题于2021年12月16日在国际权威期刊《Small》(一区,IF:13.281)在线发表。
病原性细菌感染,主要包括化脓性伤口感染和败血症,是严重威胁人类健康的常见疾病。对抗细菌感染的传统策略是使用抗生素药物,但是抗生素的滥用导致了耐药细菌的产生,这对未来抗生素的使用造成了重大威胁。作为传统抗生素治疗的潜在替代手段,利用类芬顿反应分解过氧化氢(H2O2)产生羟基自由基(•OH)的化学动力学疗法(CDT),由于其独特的氧化抗菌性能和几乎可以忽略的耐药性,已经引起了极大的关注。然而,氧化还原稳态作为细胞的一种固有防御机制,通过维持氧化剂(H2O2)和抗氧化剂(GSH)的平衡,严重限制了CDT介导的抗菌治疗。因此,合理设计能够打破细胞氧化还原稳态的多功能纳米平台具有重要意义。更重要的是,现有的纳米抗菌药物在治疗过程中不能有效的保留在感染部位,而是不可避免地扩散到其他正常组织和器官,这不仅降低了CDT的治疗效果,对正常组织和器官也造成不良的副作用。
针对上述问题,何定庚教授等人开发了一种能消耗GSH和自供应H2O2的智能纳米酶,该酶不仅能打破细菌的氧化还原稳态,还能有效保留在细菌感染部位进行局部长期CDT,实现良好的抗菌效果。在该体系中,PDA/Fe3O4纳米酶的光热治疗不仅可以直接破坏细菌,而且可以提高Fe3O4类过氧化物酶活性用于CDT。 此外,PDA/Fe3O4纳米酶通过光热增强的级联催化反应,能够消耗内源性GSH来破坏细菌氧化还原稳态,同时提供丰富的H2O2促进•OH的生成,最终增强CDT的抗菌性能。这种PDA/Fe3O4纳米酶可以与细菌结合,并对金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)显示出优异的抗菌性能。与此同时,PDA/Fe3O4纳米酶可以通过外部磁场保留在感染部位,用于体内局部长期的CDT,并且对健康组织和器官的毒性最小。这项工作提出了一种有效的策略,可以将纳米酶保留在感染部位,以实现安全、高效的CDT(DOI: 10.1002/smll.202105465)。
太阳集团电子游戏是本文的第一完成单位,公司2019级硕士研究生肖佳玉是论文的第一作者,何定庚教授为论文的通讯作者,团队负责人邓乐教授为本工作提供了重要指导。该工作得到了国家自然科学基金面上项目和湖南省重点研发计划的资助。
(论文链接: https://doi.org/10.1002/smll.202105465)
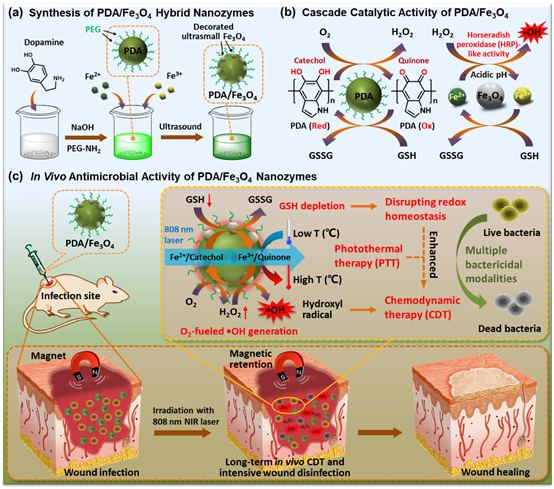
PDA/Fe3O4纳米酶通过耗尽GSH并将氧气转化为羟基自由基用于高效抗菌示意图


